塞尔帕替尼(Retevmo)
别称赛普替尼、Selpercatinib、LOXO-292
适应症塞尔帕替尼适用于非小细胞肺癌以及甲状腺髓样癌等疾病,具体适应症建议您咨询药队长医学顾问。
- 国内是否上市:是
- 是否进入医保:否
- 是否有仿制药:是
- 国内能否买到:是


别称赛普替尼、Selpercatinib、LOXO-292
适应症塞尔帕替尼适用于非小细胞肺癌以及甲状腺髓样癌等疾病,具体适应症建议您咨询药队长医学顾问。
塞普替尼(Selpercatinib、Retevmo、塞尔帕替尼)是一种高选择性RET激酶抑制剂,由美国礼来公司研发,于2020年获美国FDA批准,2022年9月在中国内地正式上市,用于治疗RET融合阳性非小细胞肺癌、RET突变型甲状腺髓样癌、RET融合阳性甲状腺癌及局部晚期或转移性RET基因融合实体瘤。该药物通过靶向抑制RET基因异常激活的信号通路,阻断肿瘤细胞增殖,显著改善患者生存期。目前塞普替尼尚未纳入国家医保目录。
1、RET 融合阳性非小细胞肺癌塞普替尼适用于治疗经美国食品药品监督管理局(FDA)批准的检测方法检测出,患有局部晚期或转移性非小细胞肺癌(NSCLC)且具有转染期间重排(RET)基因融合的成年患者。
2、RET 突变型甲状腺髓样癌塞普替尼适用于治疗经 FDA 批准的检测方法检测出,患有晚期或转移性甲状腺髓样癌(MTC)且具有 RET 突变,需要全身治疗的成年患者以及 2 岁及以上的儿科患者。
3、RET 融合阳性甲状腺癌塞普替尼适用于治疗经 FDA 批准的检测方法检测出,患有晚期或转移性甲状腺癌且具有 RET 基因融合,需要全身治疗且对放射性碘难治(如果适用放射性碘治疗)的成年患者以及 2 岁及以上的儿科患者。
4、其他 RET 融合阳性实体瘤塞普替尼适用于治疗经 FDA 批准的检测方法检测出,患有局部晚期或转移性实体瘤且具有 RET 基因融合,在先前全身治疗后进展或没有满意替代治疗方案的成年患者以及 2 岁及以上的儿科患者。
1、重要给药说明除非与质子泵抑制剂(PPI)同时使用,塞普替尼可与食物同服或空腹服用。
2、推荐剂量塞普替尼的推荐剂量见表 1:
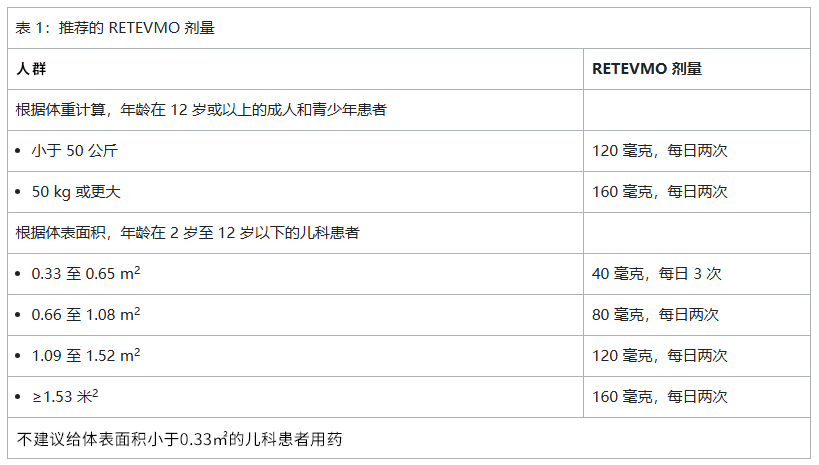
持续使用塞普替尼进行治疗,直至疾病进展或出现无法耐受的毒性。
胶囊应整粒吞服,不要压碎或咀嚼。
对于无法吞服胶囊的儿科患者,不要使用胶囊剂型。
片剂应整粒吞服,不要压碎或咀嚼。除非距离下次预定服药时间超过 6 小时,否则不要补服漏服剂量。
如果在服用塞普替尼后发生呕吐,不要额外补服,继续按预定时间服用下一剂药物。
3、与抑酸剂同时使用时的剂量调整避免塞普替尼与 PPI、组胺 - 2(H2)受体拮抗剂或局部作用的抗酸剂同时使用。如果无法避免同时使用:与 PPI 同时使用时,塞普替尼需与食物同服。与 H2 受体拮抗剂同时使用时,塞普替尼应在 H2 受体拮抗剂给药前 2 小时或给药后 10 小时服用。与局部作用的抗酸剂同时使用时,塞普替尼应在抗酸剂给药前 2 小时或给药后 2 小时服用。
最常见的不良反应 (≥25%) 包括:成年实体瘤患者:水肿、腹泻、乏力、口干、高血压、腹痛、便秘、皮疹、恶心和头痛。患有实体瘤的儿科患者:肌肉骨骼疼痛、腹泻、头痛、恶心、呕吐、冠状病毒感染、腹痛、乏力、发热和出血。最常见的 3 级或 4 级实验室异常 (≥5%) 包括:成年实体瘤患者:淋巴细胞减少,丙氨酸氨基转移酶 (ALT) 升高,天冬氨酸氨基转移酶 (AST) 升高,钠减少,钙减少。患有实体瘤的儿科患者:钙降低、血红蛋白降低和中性粒细胞减少。
尚不明确
1、肝毒性接受塞普替尼治疗的患者中,3% 发生了严重的肝脏不良反应。在开始使用塞普替尼之前监测 ALT 和 AST,在开始治疗的前 3 个月每 2 周监测一次,之后每月监测一次,并根据临床指征进行监测。根据严重程度,暂停、降低剂量或永久停用塞普替尼。
2、间质性肺疾病 / 肺炎接受塞普替尼治疗的患者可能发生严重、危及生命甚至致命的间质性肺疾病(ILD)/ 肺炎。监测提示 ILD / 肺炎的肺部症状。对于出现可能提示 ILD 的急性或恶化的呼吸道症状(如呼吸困难、咳嗽和发热)的患者,暂停使用塞普替尼并立即排查 ILD。根据确诊 ILD 的严重程度,暂停、降低剂量或永久停用塞普替尼。
3、高血压对于未控制的高血压患者,不要开始使用塞普替尼。在开始使用塞普替尼之前优化血压。开始治疗 1 周后监测血压,之后至少每月监测一次,并根据临床指征进行监测。酌情启动或调整抗高血压治疗。根据严重程度,暂停、降低剂量或永久停用塞普替尼 。
4、QT 间期延长塞普替尼可导致浓度依赖性 QT 间期延长。对有发生 QTc 延长显著风险的患者进行监测,包括已知患有长 QT 综合征、临床显著的缓慢性心律失常以及严重或未控制的心力衰竭的患者。在基线和治疗期间定期评估 QT 间期、电解质和促甲状腺激素(TSH),根据包括腹泻在内的风险因素调整评估频率。在开始使用塞普替尼之前以及治疗期间,纠正低钾血症、低镁血症和低钙血症。当塞普替尼与强效和中效 CYP3A 抑制剂或已知可延长 QTc 间期的药物同时使用时,更频繁地监测 QT 间期。根据严重程度,暂停、降低剂量或永久停用塞普替尼。
5、出血事件塞普替尼可能导致严重甚至致命的出血事件。接受塞普替尼治疗的患者中,3.1% 发生了≥3 级出血事件,包括 4 名(0.5%)致命性出血事件患者,其中脑出血 2 例、气管造口部位出血 1 例、咯血 1 例。对于严重或危及生命的出血患者,永久停用塞普替尼。
6、超敏反应6% 接受塞普替尼治疗的患者发生超敏反应,其中 1.9% 为 3 级超敏反应。超敏反应的中位发生时间为 1.9 周(范围:5 天至 2 年)。超敏反应的体征和症状包括发热、皮疹、关节痛或肌痛,同时伴有血小板减少或转氨酶升高。如果发生超敏反应,暂停使用塞普替尼,并开始使用泼尼松(或等效药物),剂量为 1mg/kg。事件缓解后,以降低后的剂量恢复使用塞普替尼,并每周增加 1 个剂量级别,直至达到超敏反应发生前的剂量,前提是患者能够耐受。在患者达到目标剂量之前持续使用类固醇药物,之后逐渐减量。如果超敏反应复发,则永久停用塞普替尼。
7、肿瘤溶解综合征接受塞普替尼治疗的甲状腺髓样癌患者中,0.6% 发生了肿瘤溶解综合征(TLS)。如果患者存在肿瘤生长迅速、肿瘤负荷高、肾功能障碍或脱水的情况,则可能有发生 TLS 的风险。密切监测有风险的患者,考虑采取适当的预防措施,包括补液,并根据临床指征进行治疗。
8、伤口愈合受损风险使用抑制血管内皮生长因子(VEGF)信号通路的药物,可能导致患者伤口愈合受损。因此,塞普替尼有可能对伤口愈合产生不利影响。在进行择期手术前,至少提前 7 天暂停使用塞普替尼。在大手术后至少 2 周内,且直至伤口充分愈合之前,不要使用塞普替尼。伤口愈合并发症解决后恢复使用塞普替尼的安全性尚未确立。
9、甲状腺功能减退塞普替尼可导致甲状腺功能减退。在使用塞普替尼治疗前监测甲状腺功能,并在治疗期间定期监测。根据临床指征,使用甲状腺激素替代治疗。根据严重程度,在临床稳定之前暂停使用塞普替尼,或永久停用塞普替尼。
10、胚胎 - 胎儿毒性根据动物生殖研究数据及其作用机制,孕妇使用塞普替尼可能会对胎儿造成伤害。在器官形成期给怀孕大鼠使用塞普替尼,当母体暴露量约等于人类推荐剂量(每天两次,每次 160mg)下的暴露量时,导致胚胎致死和畸形。告知孕妇和有生殖潜力的女性胎儿可能面临的潜在风险。建议有生殖潜力的女性在使用塞普替尼治疗期间以及最后一剂用药后 1 周内采取有效的避孕措施。建议有生殖潜力女性伴侣的男性在使用塞普替尼治疗期间以及最后一剂用药后 1 周内采取有效的避孕措施。
11、儿科患者的股骨头骨骺滑脱 / 股骨近端骨骺滑脱在 LIBRETTO - 121 研究中,1 名接受塞普替尼治疗的青少年(27 名患者中的 3.7%)和 LIBRETTO - 531 研究中 1 名接受塞普替尼治疗的青少年(193 名患者中的 0.5%)发生了股骨头骨骺滑脱 / 股骨近端骨骺滑脱(SCFE/SUFE)。监测患者是否出现提示 SCFE/SUFE 的症状,并进行适当的医学和外科治疗。
1、孕妇根据动物研究结果及其作用机制,孕妇使用塞普替尼可能会对胎儿造成伤害。目前尚无孕妇使用塞普替尼的数据来明确药物相关风险。在器官形成期给怀孕大鼠使用塞普替尼,当母体暴露量约等于人类临床剂量(每天两次,每次 160mg)的暴露量时,会导致胚胎致死和畸形。告知孕妇胎儿可能面临的潜在风险。
2、哺乳期目前尚无关于塞普替尼及其代谢物是否存在于人乳中、对母乳喂养婴儿的影响或对乳汁分泌影响的数据。由于母乳喂养的婴儿可能出现严重不良反应,建议女性在使用塞普替尼治疗期间及最后一剂用药后 1 周内不要进行母乳喂养。
3、有生殖潜力的女性和男性在开始使用塞普替尼之前,确认有生殖潜力女性的妊娠状态。建议有生殖潜力的女性患者在使用塞普替尼治疗期间及最后一剂用药后 1 周内采取有效的避孕措施。建议有生殖潜力女性伴侣的男性在使用塞普替尼治疗期间及最后一剂用药后 1 周内采取有效的避孕措施。
4、儿科用药塞普替尼在 2 岁及以上儿科患者中治疗以下疾病的安全性和有效性已得到证实:携带 RET 突变、需要全身治疗的晚期或转移性甲状腺髓样癌(MTC);携带 RET 基因融合、需要全身治疗且对放射性碘难治(如果适用放射性碘治疗)的晚期或转移性甲状腺癌;携带 RET 基因融合、在先前全身治疗后进展或无满意替代治疗方案的局部晚期或转移性实体瘤。成人和儿科患者的充分且严格对照的研究为塞普替尼用于这些适应症提供了证据支持,并且有 2 岁及以上儿科患者的药代动力学和安全性数据作为补充。儿科患者按推荐剂量使用塞普替尼的预测暴露量,在体重≥12 岁且≥50kg 的患者接受批准的推荐剂量(每天两次,每次 160mg)时的预测值范围内。塞普替尼在儿科患者中用于其他适应症的安全性和有效性尚未确立。
5、老年用药在 796 名接受塞普替尼治疗的患者中,34%(268 名患者)年龄≥65 岁,9%(74 名患者)年龄≥75 岁。≥65 岁患者与较年轻患者在塞普替尼的安全性或有效性方面未观察到总体差异。
6、肾功能损害对于轻度至重度肾功能损害患者,不建议调整剂量。对于终末期肾病(ESRD)患者,尚未确定推荐剂量。
7、肝功能损害给严重肝功能损害患者使用塞普替尼时,需降低剂量。对于轻度(总胆红素小于或等于 ULN 且 AST 大于 ULN,或总胆红素大于 1 至 1.5 倍 ULN 且任何 AST 水平)或中度(总胆红素大于 1.5 至 3 倍 ULN 且任何 AST 水平)肝功能损害患者,不建议调整剂量。对肝功能损害患者监测与塞普替尼相关的不良反应。
1、其他药物对塞普替尼的影响抑酸剂:塞普替尼与抑酸剂同时使用会降低塞普替尼的血浆浓度,这可能会降低塞普替尼的抗肿瘤活性。避免塞普替尼与质子泵抑制剂(PPIs)、H2 受体拮抗剂和局部作用的抗酸剂同时使用。如果无法避免同时使用,服用质子泵抑制剂时,塞普替尼需与食物同服;服用 H2 受体拮抗剂或局部作用的抗酸剂时,需调整塞普替尼的给药时间。
强效和中效 CYP3A 抑制剂:塞普替尼与强效或中效 CYP3A 抑制剂同时使用会增加塞普替尼的血浆浓度,这可能会增加塞普替尼不良反应的风险,包括 QT 间期延长。避免塞普替尼与强效和中效 CYP3A 抑制剂同时使用。如果无法避免同时使用,需降低塞普替尼的剂量,并更频繁地通过心电图监测 QT 间期。
强效和中效 CYP3A 诱导剂:塞普替尼与强效或中效 CYP3A 诱导剂同时使用会降低塞普替尼的血浆浓度,这可能会降低塞普替尼的抗肿瘤活性。避免塞普替尼与强效或中效 CYP3A 诱导剂共同给药。
2、塞普替尼对其他药物的影响CYP2C8 和 CYP3A 底物:塞普替尼是一种中效 CYP2C8 抑制剂和弱效 CYP3A 抑制剂。塞普替尼与 CYP2C8 和 CYP3A 底物同时使用会增加这些底物的血浆浓度,这可能会增加与这些底物相关的不良反应风险。避免塞普替尼与浓度稍有变化就可能增加不良反应的 CYP2C8 和 CYP3A 底物共同给药。如果无法避免同时使用,请遵循这些底物获批产品标签中给出的建议。某些 P - 糖蛋白(P - gp)和乳腺癌耐药蛋白(BCRP)底物:塞普替尼是一种 P - gp 和 BCRP 抑制剂。塞普替尼与 P - gp 或 BCRP 底物同时使用会增加这些底物的血浆浓度,这可能会增加与这些底物相关的不良反应风险。避免塞普替尼与浓度稍有变化就可能增加不良反应的 P - gp 或 BCRP 底物共同给药。如果无法避免同时使用,请遵循这些底物获批产品标签中给出的建议。
3、延长 QT 间期的药物塞普替尼与 QT 间期延长有关。对于需要同时使用已知会延长 QT 间期药物的患者,应更频繁地通过心电图监测 QT 间期。
尚不明确
在局部晚期或转移性实体瘤患者中评估了塞普替尼胶囊的药代动力学,除非另有说明,患者的给药剂量为每日两次,每次 160mg。塞普替尼的胶囊和片剂剂型具有生物等效性。在每日一次 20mg 至每日两次 240mg 的剂量范围内(即最大推荐日总剂量的 0.06 至 1.5 倍),稳态塞普替尼的药时曲线下面积(AUC)和血药峰浓度(Cmax)的增加幅度略大于剂量比例。大约 7 天达到稳态,每日两次服用 160mg 后的中位蓄积比为 3.4 倍。稳态时,塞普替尼的平均(变异系数 CV%)Cmax 为 2980(53%)ng/mL,0-24 小时的 AUC 为 51600(58%)ng・h/mL。吸收塞普替尼的达峰时间(tmax)中位数为 2 小时。在健康受试者中,赛普替尼(RETEVMO)胶囊的平均绝对生物利用度为 73%(60% - 82%)。食物的影响在健康受试者中,无论是胶囊还是片剂剂型,服用高脂肪餐(约 900 卡路里,含 58 克碳水化合物、56 克脂肪和 43 克蛋白质)后,塞普替尼的 AUC 或 Cmax 均未观察到具有临床意义的差异。分布塞普替尼的表观分布容积(Vss/F)为 203L。
塞普替尼在体外的蛋白结合率为 96%,且与浓度无关。血药浓度与血浆浓度之比为 0.7。消除在患者中,塞普替尼的表观清除率(CL/F)为 6L/h;在健康受试者中口服塞普替尼后,其半衰期为 32 小时。代谢塞普替尼主要经 CYP3A4 代谢。给健康受试者单次口服 160mg 放射性标记的塞普替尼后,血浆中放射性药物成分的 86% 为未代谢的塞普替尼。排泄给健康受试者单次口服 160mg 放射性标记的塞普替尼后,给药剂量的 69% 经粪便排出(其中 14% 为未代谢的药物),24% 经尿液排出(其中 12% 为未代谢的药物)。
本网站不销售任何药品,只做药品信息资讯展示 鲁ICP备2023035557号-5 证书编号:(鲁)-经营性-2022-0196 找药网 找药助手