
敬畏生命,为爱发声
医疗无国界,健康伴您行

免费咨询电话
400 - 001 - 2811

在线人工客服
09:00 ~ 23:00

敬畏生命,为爱发声
医疗无国界,健康伴您行

免费咨询电话
400 - 001 - 2811

在线人工客服
09:00 ~ 23:00
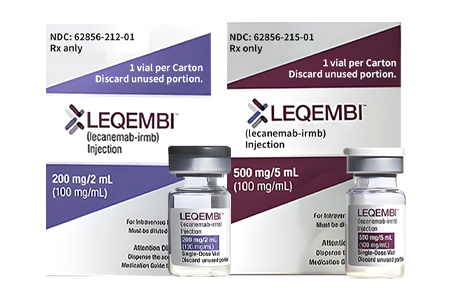

别称仑卡奈单抗、Leqembi、乐卡奈单抗、lecanemab-irmb
适应症适用于治疗处于轻度认知障碍或轻度痴呆阶段的阿尔茨海默病患者。治疗需基于淀粉样蛋白β病理学确认,且需在临床试验验证的人群中启动。
仑卡奈单抗适用于治疗阿尔茨海默病。应在患有轻度认知障碍或疾病处于轻度痴呆阶段的患者中开始使用仑卡奈单抗进行治疗,临床试验中即针对这部分人群启动治疗。
lecanemab
500 mg/5 mL (100 mg/mL) 、200 mg/2 mL (100 mg/mL)
仑卡奈单抗为澄清至微浑浊、无色至淡黄色溶液,剂型如下:
注射剂:单剂量药瓶,500mg/5mL(100mg/mL)
注射剂:单剂量药瓶,200mg/2mL(100mg/mL)
24个月
未开封的样品瓶,存放在 2°C 至 8°C(36°F 至 46°F)的冰箱中。存放在原纸箱中,避光。请勿冻结或摇晃。
在开始治疗前,需确认患者存在 β - 淀粉样蛋白病变。
仑卡奈单抗推荐的初始给药方案为每 2 周静脉输注 1 次,剂量为 10mg/kg,输注时间约 1 小时。18 个月后,可继续每 2 周 1 次、每次 10mg/kg 的给药方案,或考虑过渡到每 4 周 1 次、每次 10mg/kg 的维持给药方案。
仑卡奈单抗在给药前必须进行稀释。
如果漏输,应尽快输注下一次剂量。
仑卡奈单抗可引起淀粉样蛋白相关影像学异常 - 水肿(ARIA - E)和 - 含铁血黄素沉积(ARIA - H)。
ARIA 监测
在开始使用仑卡奈单抗治疗前,需获取近期的脑部磁共振成像(MRI)基线数据。在第 5 次、第 7 次和第 14 次输注前进行 MRI 检查。如果患者出现提示 ARIA 的症状,应进行临床评估,必要时包括 MRI 检查。
给药前,必须将仑卡奈单抗稀释于 250mL 的 0.9% 氯化钠注射液(USP)中。
制备用于静脉输注的仑卡奈单抗稀释溶液时,需采用无菌技术。
根据患者实际体重和 10mg/kg 的推荐剂量,计算所需剂量(mg)、仑卡奈单抗溶液总体积(mL)以及所需药瓶数量。每瓶仑卡奈单抗的浓度为 100mg/mL。
只要溶液和容器允许,在给药前应目视检查肠胃外药品有无颗粒物质和变色情况。检查仑卡奈单抗溶液应澄清至微浑浊、无色至淡黄色。若有不透明颗粒、变色或其他异物,则不可使用。
取下药瓶的易开瓶盖。将无菌注射器针头从橡胶塞中心插入药瓶。
从药瓶中抽取所需体积的仑卡奈单抗,加入含有 250mL 0.9% 氯化钠注射液(USP)的输液袋中。
每个药瓶仅供一次性使用。丢弃任何未使用的部分。
轻轻倒置装有仑卡奈单抗稀释溶液的输液袋,使其完全混合。请勿摇晃。
稀释后,建议立即使用。若不立即给药,可将仑卡奈单抗冷藏于 2°C - 8°C(36°F - 46°F)环境下,最长保存 4 小时;或在室温(最高 30°C,即 86°F)下保存,最长 4 小时。切勿冷冻。
给药前,目视检查仑卡奈单抗稀释溶液有无颗粒或变色情况。若溶液变色、浑浊或有异物,则不可使用。
输注前,让仑卡奈单抗稀释溶液升温至室温。
通过含有末端低蛋白结合 0.2 微米在线过滤器的静脉输液管,将全部体积的仑卡奈单抗稀释溶液在约 1 小时内静脉输注完毕。冲洗输液管,确保所有仑卡奈单抗都已输注。
监测有无输液相关反应的任何体征或症状。根据临床情况,可降低输液速度、停止输液,并给予适当治疗。后续给药时,可考虑使用抗组胺药、非甾体抗炎药或皮质类固醇进行预处理。
最常见的不良反应(与安慰剂相比,发生率约 10% 及以上):输液相关反应、淀粉样蛋白相关影像学异常 - 微出血、淀粉样蛋白相关影像学异常 - 水肿 / 积液和头痛。
对仑卡奈单抗或仑卡奈单抗任何辅料严重过敏的患者禁用该药。过敏反应包括血管性水肿和过敏反应。
包括仑卡奈单抗在内,针对聚集形式 β - 淀粉样蛋白的单克隆抗体,可能会引发淀粉样蛋白相关影像学异常(ARIA),主要表现为伴有水肿的 ARIA(ARIA - E)和伴有含铁血黄素沉积的 ARIA(ARIA - H)。不同治疗手段下,ARIA 的发生率和出现时间有所不同。ARIA 通常在治疗早期出现,大多没有症状,但也可能引发严重甚至危及生命的情况,ARIA 甚至可能致命。使用这类药物治疗的患者中,曾观察到直径大于 1 厘米的严重脑出血,部分脑出血甚至导致死亡。由于 ARIA - E 会导致局灶性神经功能缺损,症状类似缺血性中风,因此在为接受仑卡奈单抗治疗的患者进行溶栓治疗前,治疗医生应考虑这些症状是否由 ARIA - E 引起。
ApoE ε4 纯合子
与杂合子和非携带者相比,接受包括仑卡奈单抗在内的这类药物治疗的载脂蛋白 E ε4(ApoE ε4)纯合子患者(约占阿尔茨海默病患者的 15%),发生 ARIA 的概率更高,包括有症状的、严重的以及影像学表现严重的 ARIA。在开始治疗前应检测 ApoE ε4 状态,以便了解发生 ARIA 的风险。检测前,处方医生应与患者讨论不同基因型发生 ARIA 的风险,以及基因检测结果的意义。处方医生还应告知患者,如果不进行基因型检测,仍可使用仑卡奈单抗治疗;但无法确定他们是否为 ApoE ε4 纯合子,以及是否具有更高的 ARIA 发生风险。
在决定开始使用仑卡奈单抗治疗时,应权衡其治疗阿尔茨海默病的益处,以及与 ARIA 相关的严重不良事件的潜在风险。
接受仑卡奈单抗治疗的患者出现过过敏反应,包括血管性水肿、支气管痉挛和过敏症。一旦观察到任何与过敏反应相符的体征或症状,应立即停止输液,并开展适当的治疗。对仑卡奈单抗 - irmb 或仑卡奈单抗的任何辅料有严重过敏史的患者,禁用仑卡奈单抗。
在研究 2 中,接受仑卡奈单抗治疗的患者里,26%(237/898)出现了输液相关反应,而安慰剂组为 7%(66/897);其中大多数(75%,178/237)发生在首次输液时。输液相关反应大多为轻度(69%)或中度(28%)。输液相关反应导致 1%(12/898)接受仑卡奈单抗治疗的患者停止治疗。输液相关反应的症状包括发热、流感样症状(寒战、全身酸痛、颤抖、关节疼痛)、恶心、呕吐、低血压、高血压和血氧饱和度下降。
在研究 1 中,首次输液后,38% 接受仑卡奈单抗治疗的患者淋巴细胞计数暂时降至低于 0.9×10⁹/L,而安慰剂组为 2%;22% 接受仑卡奈单抗治疗的患者中性粒细胞计数暂时升至高于 7.9×10⁹/L,而安慰剂组为 1%。研究 2 中未在首次输液后检测淋巴细胞和中性粒细胞计数。
如果发生输液相关反应,可根据临床情况降低输液速度、停止输液,并开始适当的治疗。在未来输液前,可考虑使用抗组胺药、对乙酰氨基酚、非甾体抗炎药或皮质类固醇进行预防性治疗。
目前尚无足够数据评估孕妇使用仑卡奈单抗是否会导致重大出生缺陷、流产或其他对母体及胎儿的不良后果。也未开展动物研究评估仑卡奈单抗的潜在生殖或发育毒性。
目前尚无关于仑卡奈单抗是否存在于人乳中、对母乳喂养婴儿的影响或对乳汁分泌影响的数据。其他单克隆抗体的已发表数据通常表明,单克隆抗体进入人乳的量较低,母乳喂养婴儿的全身暴露量有限。这种有限暴露的影响尚不清楚。应综合考虑母乳喂养对婴儿发育和健康的益处、母亲对仑卡奈单抗的临床需求,以及仑卡奈单抗或母体潜在疾病对母乳喂养婴儿的任何潜在不良影响。
仑卡奈单抗在儿科患者中的安全性和有效性尚未确立。
在研究 1 和研究 2 中,接受每 2 周 10mg/kg 仑卡奈单抗治疗(n = 1059)的患者年龄在 50 - 90 岁之间,平均年龄为 72 岁;81% 的患者年龄在 65 岁及以上,39% 的患者年龄在 75 岁及以上。在 65 岁及以上患者和较年轻的成年患者之间,未观察到仑卡奈单抗在安全性或有效性方面存在总体差异。
尚不明确
尚不明确
每 2 周给予 10mg/kg 的仑卡奈单抗,6 周后达到稳态浓度,全身蓄积为 1.4 倍。单剂量给药后,在 0.3 - 15mg/kg 的剂量范围内,仑卡奈单抗的血药峰浓度(Cmax)和血浆浓度 - 时间曲线下面积(AUC)呈剂量比例增加。
在每 2 周接受 10mg/kg 剂量的患者中,稳态浓度的平均值(± 标准差)估计为 148(±50)mcg/mL。在每 4 周接受 10mg/kg 剂量的患者中,稳态浓度的平均值(± 标准差)估计为 71.2(±20)mcg/mL。
稳态时中央室分布容积的平均值(95% 置信区间)为 3.24(3.18 - 3.30)L。
仑卡奈单抗与内源性免疫球蛋白 G(IgGs)一样,通过蛋白水解酶降解。仑卡奈单抗的清除率(95% 置信区间)为 0.370(0.353 - 0.384)L / 天,终末半衰期为 5 - 7 天。
性别、体重和白蛋白被发现会影响仑卡奈单抗的暴露量。然而,这些协变量均未显示出具有临床意义。
肾或肝功能损害患者:未开展临床研究评估肾或肝功能损害患者中仑卡奈单抗的药代动力学。仑卡奈单抗通过蛋白水解酶降解,预计不会经肾脏消除或由肝酶代谢。
仑卡奈单抗是一种专门针对阿尔茨海默病的新型药物,其疗效主要通过减少大脑中的β-淀粉样蛋白沉积来实现。本文将详细介绍仑卡奈单抗的中文说明书、医保覆盖情况、价格、疗效和副作用等内容,帮···【详情】
文章来源:找药网发布时间:2025-05-06 11:29:32推荐指数:1310
仑卡奈单抗是一种专门针对阿尔茨海默病的新型药物,其疗效主要通过减少大脑中的β-淀粉样蛋白沉积···【详情】
推荐指数:13102025-05-06
乐卡奈单抗是一种用于治疗特定疾病的有效药物,其副作用相对较少见,但了解并缓解这些可能发生的不···【详情】
推荐指数:13242025-05-06
阿尔茨海默症是一种常见的神经退行性疾病,全球范围内影响着大量患者的生活质量。近年来,一种名为···【详情】
推荐指数:14752025-05-06
仑卡奈单抗,这一针对阿尔茨海默病的新型生物制剂,在中国市场的引入为众多患者带来了新的治疗希望···【详情】
推荐指数:13722025-05-06
仑卡奈单抗是一种用于治疗阿尔茨海默症的新型单克隆抗体,随着科技的进步和医学的发展,这类药物逐···【详情】
推荐指数:14042025-05-06
近年来,医学界在阿尔茨海默病(AD)治疗领域的研究不断取得新进展,仑卡奈单抗(Leqembi···【详情】
推荐指数:13612025-05-06
在医疗领域,乐卡奈单抗(Lecanemab)是一种针对阿尔茨海默病的新型治疗药物。它的问世为···【详情】
推荐指数:13262025-05-06
乐卡奈单抗是一种用于治疗阿尔茨海默病的药物,其价格在国内市场上一直备受关注。由于这种药物的价···【详情】
推荐指数:13352025-05-06
本网站不销售任何药品,只做药品信息资讯展示 鲁ICP备2023035557号-5 证书编号:(鲁)-经营性-2022-0196 找药网 找药助手