
敬畏生命,为爱发声
医疗无国界,健康伴您行

免费咨询电话
400 - 001 - 2811

在线人工客服
09:00 ~ 23:00

敬畏生命,为爱发声
医疗无国界,健康伴您行

免费咨询电话
400 - 001 - 2811

在线人工客服
09:00 ~ 23:00

别称talvey、他奎他单抗、拓立珂
适应症适用于治疗复发或难治性多发性骨髓血液疾病患者,尤其是经过至少三种先前系统性治疗方案(包括蛋白酶体抑制剂、免疫调节剂及抗CD38单抗)治疗失败的患者
塔奎妥单抗适用于治疗成年复发或难治性多发性骨髓瘤患者,这些患者此前至少接受过四线治疗,其中包括蛋白酶体抑制剂、免疫调节剂和抗 CD38 单克隆抗体。
talquetamab
3 mg/1.5 mL (2 mg/mL)、40 mg/mL
注射液:3mg/1.5 mL (2 mg/mL) 无色至浅黄色溶液,装在单剂量样品瓶中40mg/mL 无色至淡黄色溶液,装在单剂量样品瓶中
制备后 24小时
在2°C至8°C(36°F至46°F)的冰箱中避光储存。不要冻结。
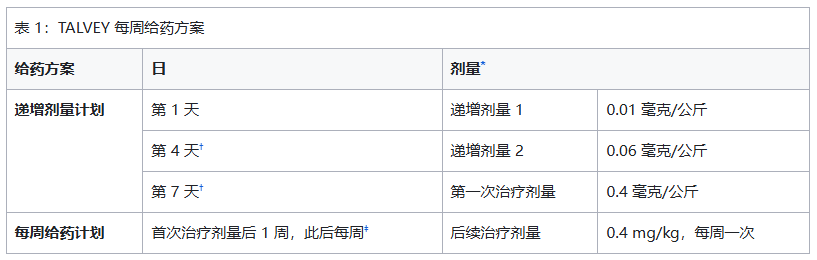
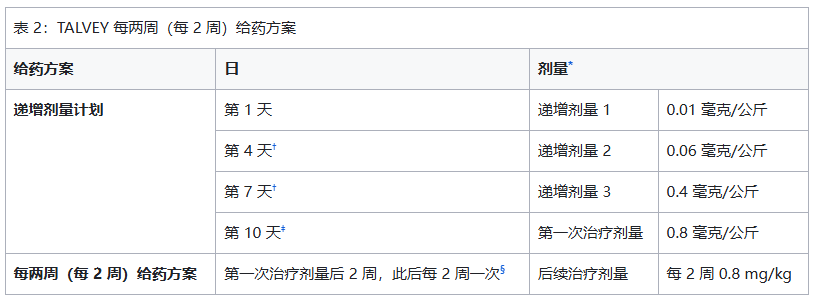
皮下注射给药。在起始剂量递增方案中,每次注射塔奎妥单抗之前都要使用预处理药物。
根据表 1 或表 2,按每周或每两周(每 2 周)一次的给药方案进行塔奎妥单抗皮下注射。持续治疗直至疾病进展或出现无法耐受的毒性。
发热、CRS、味觉障碍、指甲疾病、肌肉骨骼疼痛、皮肤病、皮疹、疲劳、体重减轻、口干、干燥、吞咽困难、上呼吸道感染、腹泻、低血压和头痛。
淋巴细胞计数减少、中性粒细胞计数减少、白细胞减少和血红蛋白减少。
尚不明确
塔奎妥单抗可导致细胞因子释放综合征,包括危及生命或致命的反应。告知患者若出现 CRS 的体征或症状应寻求医疗帮助。一旦出现 CRS 迹象,立即评估患者是否需要住院,并根据严重程度提供支持性治疗,同时参考现行临床实践指南考虑进一步的处理措施。在 CRS 缓解前暂停使用塔奎妥单抗,或根据严重程度永久停药。
塔奎妥单抗可导致严重、危及生命或致命的神经毒性,包括 ICANS。治疗期间监测患者是否出现神经毒性的体征和症状。一旦出现包括 ICANS 在内的神经毒性迹象,立即评估患者并根据严重程度提供支持性治疗;根据严重程度暂停或永久停用塔奎妥单抗,并参考现行临床实践指南考虑进一步的处理措施。由于存在神经毒性的潜在风险,接受塔奎妥单抗治疗的患者有出现意识水平下降的风险。建议患者在起始剂量递增方案期间、完成递增方案后的 48 小时内,以及出现任何新发神经系统症状时,直至症状缓解,都不要驾驶或操作重型或具有潜在危险的机械。
塔奎妥单抗可导致口腔毒性,包括味觉障碍、口干、吞咽困难和口腔炎。监测患者是否出现口腔毒性的体征和症状。告知患者若出现口腔毒性的体征或症状应寻求医疗帮助,并根据现行临床实践提供支持性治疗,包括咨询营养师。治疗期间定期监测体重,对具有临床意义的体重减轻进行进一步评估。根据严重程度暂停或永久停用塔奎妥单抗。
塔奎妥单抗可导致严重感染,包括危及生命或致命的感染。在临床试验中,16% 的患者发生严重感染,1.5% 的患者发生致命感染。17% 的患者发生 3 级或 4 级感染。报告的最常见严重感染为细菌感染(8%,包括败血症)和新冠肺炎(2.7%)。在使用塔奎妥单抗治疗前和治疗期间监测患者是否出现感染的体征和症状,并进行适当治疗。根据当地指南给予预防性抗菌药物。根据严重程度,按建议暂停或考虑永久停用塔奎妥单抗。
塔奎妥单抗可导致血细胞减少,包括中性粒细胞减少和血小板减少。治疗期间监测全血细胞计数,并根据严重程度按建议暂停使用塔奎妥单抗。
塔奎妥单抗可导致严重的皮肤反应,包括皮疹、斑丘疹、红斑和红斑疹。监测皮肤毒性,包括皮疹进展情况。考虑早期干预和治疗以控制皮肤毒性。根据严重程度按建议暂停使用塔奎妥单抗。
塔奎妥单抗可导致肝毒性。在临床试验中,33% 的患者谷丙转氨酶(ALT)升高,其中 2.7% 为 3 级或 4 级升高;31% 的患者谷草转氨酶(AST)升高,其中 3.3% 为 3 级或 4 级升高。0.3% 的患者总胆红素出现 3 级或 4 级升高。肝酶升高可与 CRS 同时发生,也可单独出现。在基线及治疗期间,根据临床指征监测肝酶和胆红素。根据严重程度暂停使用塔奎妥单抗或考虑永久停用塔奎妥单抗。
基于其作用机制,孕妇使用塔奎妥单抗可能会对胎儿造成伤害。告知孕妇胎儿可能面临的潜在风险。建议有生殖潜力的女性在使用塔奎妥单抗治疗期间及最后一剂用药后 3 个月内采取有效的避孕措施。
基于作用机制,孕妇使用塔奎妥单抗可能会对胎儿造成伤害。目前尚无孕妇使用塔奎妥单抗的数据来评估其药物相关风险。尚未开展过塔奎妥单抗的动物生殖或发育毒性研究。告知女性胎儿可能面临的潜在风险。
目前尚无关于塔奎妥单抗是否存在于人乳中、对母乳喂养婴儿的影响,或对乳汁分泌影响的相关信息。已知母体 IgG 存在于人乳中。母乳喂养婴儿局部胃肠道暴露和有限的全身暴露于塔奎妥单抗的影响尚不清楚。由于母乳喂养的婴儿可能会出现严重不良反应,建议女性在使用塔奎妥单抗治疗期间及最后一剂用药后 3 个月内不要进行母乳喂养。
在开始使用塔奎妥单抗之前,确认有生殖潜力女性的妊娠状态。建议有生殖潜力的女性在使用塔奎妥单抗治疗期间及最后一剂用药后 3 个月内采取有效的避孕措施。
塔奎妥单抗在儿科患者中的安全性和有效性尚未确立。
在复发或难治性多发性骨髓瘤的临床试验中,共有 339 名患者。在接受塔奎妥单抗治疗的患者总数中,178 名(53%)患者年龄在 65 岁及以上,而 57 名(17%)患者年龄在 75 岁及以上。与较年轻患者相比,65 岁至 74 岁以下的患者在安全性或有效性方面未观察到总体差异。与较年轻患者相比,75 岁及以上患者发生致命不良反应的比例更高。临床研究中纳入的 75 岁及以上患者数量不足,无法确定他们与较年轻患者的反应是否存在差异。
对于某些细胞色素 P450(CYP)底物,其浓度的微小变化都可能导致严重不良反应。当塔奎妥单抗(TALVEY)与这些 CYP 底物合用时,需监测其毒性或药物浓度。
塔奎妥单抗会引起细胞因子释放,这可能会抑制 CYP 酶的活性,从而导致 CYP 底物的暴露量增加。从塔奎妥单抗起始剂量递增方案开始至首次治疗剂量后的 14 天内,以及在细胞因子释放综合征(CRS)期间和之后,CYP 底物的暴露量更有可能增加。
尚不明确
吸收:塔奎妥单抗皮下注射生物利用度为59%,Cmax和AUCtau在治疗剂量范围内呈剂量比例性增加,首次给药后16周达稳态暴露量的90%,达峰时间(Tmax)随给药次数缩短(每周方案)或保持相近(每两周方案)。
分布:分布容积为10.1L,随体重增加而增大。
消除:清除率在首次给药后16周内下降40%,终末半衰期从8.4天延长至12.2天。
代谢:通过分解代谢途径转化为小肽。
特殊人群:体重影响药代参数,但年龄、性别、种族、轻中度肝肾损无显著影响,严重肝肾损影响未知。
塔奎妥单抗(talvey)作为靶向GPRC5D/CD3的双特异性抗体,在治疗复发/难治性多发···【详情】
推荐指数:12552025-08-21
他奎他单抗(talquetamab)作为新型靶向治疗药物,其严重副作用涉及多个器官系统,部分···【详情】
推荐指数:12632025-08-21
塔奎妥单抗(talquetamab)作为治疗多发性骨髓瘤的新型免疫疗法,其不良反应谱从轻度可···【详情】
推荐指数:12652025-08-21
他奎他单抗(talquetamab)作为靶向治疗药物,其不良反应谱涉及多个系统,从常见的轻微···【详情】
推荐指数:12702025-08-21
塔奎妥单抗(talquetamab)作为治疗多发性骨髓瘤的新型双特异性抗体药物,其副作用谱涉···【详情】
推荐指数:12762025-08-21
塔奎妥单抗(talquetamab)作为FDA批准的靶向治疗药物,其使用过程中涉及多项关键注···【详情】
推荐指数:12772025-08-21
塔奎妥单抗(talvey)作为治疗多发性骨髓瘤的新型免疫疗法,其保存条件直接影响药物疗效和安···【详情】
推荐指数:12742025-08-21
他奎他单抗(talquetamab)是一种用于治疗多发性骨髓瘤的生物制剂,其使用过程中需特别···【详情】
推荐指数:12562025-08-21
本网站不销售任何药品,只做药品信息资讯展示 鲁ICP备2023035557号-5 证书编号:(鲁)-经营性-2022-0196 找药网 找药助手